Aminoácido
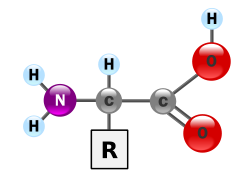
Estrutura geral de um aminoácido
Aminoácidos são compostos quaternários de carbono (C), hidrogênio (H), oxigênio (O) e nitrogênio (N) - também chamado de azoto em Portugal - às vezes contêm enxofre (S), como a cisteína.[1] A estrutura geral dos aminoácidos envolve um grupo amina e um grupo carboxilo, ambos ligados ao carbono α (o primeiro depois do grupo carboxílico). O carbono α também é ligado a um hidrogénio e a uma cadeia lateral, que é representada pela letra R. O grupo R determina a identidade de um aminoácido específico. A fórmula bidimensional mostrada aqui pode transmitir somente parte da estrutura comum dos aminoácidos, porque uma das propriedades mais importantes de tais compostos é a forma tridimensional, ou estereoquímica. Os aminoácidos são classificados em polares, não-polares e neutros, dependendo da natureza da cadeia lateral.[2]
Existem 20 aminoácidos principais, sendo denominados aminoácidos primários ou padrão, mas, além desses, existem alguns aminoácidos especiais, que só aparecem em alguns tipos de proteínas. Desses 20, nove são ditos essenciais: isoleucina, leucina, valina, fenilalanina, metionina, treonina, triptofano, lisina e histidina. O organismo humano não é capaz de produzi-los, e por isso é necessária a sua ingestão através dos alimentos para evitar a sua deficiência no organismo. Uma cadeia de aminoácidos denomina-se de "peptídeo", esta pode possuir dois aminoácidos (dipeptídeos), três aminoácidos (tripeptídeos), quatro aminoácidos (tetrapeptídeos), ou muitos aminoácidos (polipeptídeos). O termo proteína é dado quando há entre centenas e milhares de aminoácidos na composição do polipeptídeo.
As ligações entre aminoácidos denominam-se ligações peptídicas e estabelecem-se entre o grupo amina e o grupo carboxilo de dois aminoácidos diferentes, com a perda de uma molécula de água.[3] Os aminoácidos são moléculas anfóteras, ou seja, podem se comportar como ácido ou como base, liberando, nesta ordem, H ou OH em uma reação. Se a reação for entre dois aminoácidos, o grupo amina de um libera um H se ligando ao grupo carboxila do outro que libera um OH, formando uma peptídeo mais H2O.
A forma mais importante dos aminoácidos, os alfa-aminoácidos, que constituem as proteínas, tem geralmente, como estrutura, um carbono central (carbono alfa, quase sempre quiral) ao qual se ligam quatro grupos: o grupo amina (NH2), grupo carboxílico (COOH), hidrogênio e um substituinte característico de cada aminoácido.[2][4]
Índice
1 Aminoácidos
1.1 Fórmula geral
1.2 Outros aminoácidos encontrados na natureza
2 Simbologia e nomenclatura
3 Estrutura
3.1 Estrutura tridimensional
3.1.1 Aminoácidos apolares
3.1.2 Aminoácidos polares neutros
3.1.3 Aminoácidos polares ácidos
3.1.4 Aminoácidos polares básicos
4 Classificação quanto ao substituinte
5 Propriedades
5.1 Tabela de abreviaturas e propriedades padrão de aminoácidos
6 Curva de titulação
7 Classificação quanto ao destino
7.1 Destino cetogênico
7.2 Destino glicogênico
8 Classificação nutricional
8.1 Aminoácidos não-essenciais
8.2 Aminoácidos essenciais
8.3 Aminoácidos essenciais apenas em determinadas situações fisiológicas
9 Isomeria
10 Síntese
11 Obtenção
12 Ionização
13 Outros aminoácidos
13.1 Aminoácidos ômega
14 Notas
15 Referências
16 Bibliografia
17 Ver também
18 Ligações externas
Aminoácidos |
Os aminoácidos alfa (cerca de vinte) são constituintes de todas as proteínas e peptídeos, portanto, de toda a matéria viva.
Todos os aminoácidos constituintes das proteínas são alfa-aminoácidos. As proteínas são alfa-polímeros formados por alfa-aminoácidos. Alguns autores relatam que para formar uma proteína é necessário uma cadeia com mais de 50 aminoácidos. Uma cadeia formada por dois alfa aminoácidos é um dipeptídeo, até 50 alfa-aminoácido um polipeptídeo.
Fórmula geral |
São aqueles que apresentam fórmula geral: R - CH (NH2)- COOH na qual R é uma cadeia orgânica. [Nota 1] No aminoácido glicina o substituinte é o hidrogênio; O carbono ligado ao substituinte R é denominado carbono 2 ou alfa. Os vários alfa-aminoácidos diferem em qual cadeia lateral (grupo- R) está ligado o seu carbono alfa, e podem variar em tamanho a partir de apenas um átomo de hidrogénio na glicina a um grupo heterocíclico grande, como no caso do triptofano.
Outros aminoácidos encontrados na natureza |
Ornitina e citrulina são α-aminoácidos que desempenham um papel vital no corpo. Eles são usados como parte do ciclo da ureia para se livrar dos iões de amónio que, de outro modo, iriam nos envenenar. No entanto, não são utilizados como blocos de construção na síntese de polipéptidos.[5]
Simbologia e nomenclatura |
Na nomenclatura dos aminoácidos, a numeração dos carbonos da cadeia principal é iniciada a partir do carbono da carboxila.
| Nome | Símbolo | Abreviação | Nomenclatura |
Glicina ou Glicocola | Gly, Gli | G | Ácido 2-aminoacético ou Ácido 2-amino-etanóico |
Alanina | Ala | A | Ácido 2-aminopropiônico ou Ácido 2-amino-propanóico |
Leucina | Leu | L | Ácido 2-aminoisocapróico ou Ácido 2-amino-4-metil-pentanóico |
Valina | Val | V | Ácido 2-aminovalérico ou Ácido 2-amino-3-metil-butanóico |
Isoleucina | Ile | I | Ácido 2-amino-3-metil-n-valérico ou ácido 2-amino-3-metil-pentanóico |
Prolina | Pro | P | Ácido pirrolidino-2-carboxílíco |
Fenilalanina | Phe ou Fen | F | Ácido 2-amino-3-fenil-propiônico ou Ácido 2-amino-3-fenil-propanóico |
Serina | Ser | S | Ácido 2-amino-3-hidroxi-propiônico ou Ácido 2-amino-3-hidroxi-propanóico |
Treonina | Thr, Tre | T | Ácido 2-amino-3-hidroxi-n-butírico |
Cisteina | Cys, Cis | C | Ácido 2-bis-(2-amino-propiônico)-3-dissulfeto ou Ácido 3-tiol-2-amino-propanóico |
Tirosina | Tyr, Tir | Y | Ácido 2-amino-3-(p-hidroxifenil)propiônico ou paraidroxifenilalanina |
Asparagina | Asn | N | Ácido 2-aminossuccionâmico |
Glutamina | Gln | Q | Ácido 2-aminoglutarâmico |
Aspartato ou Ácido aspártico | Asp | D | Ácido 2-aminossuccínico ou Ácido 2-amino-butanodióico |
Glutamato ou Ácido glutâmico | Glu | E | Ácido 2-aminoglutárico |
Arginina | Arg | R | Ácido 2-amino-4-guanidina-n-valérico |
Lisina | Lys, Lis | K | Ácido 2,6-diaminocapróico ou Ácido 2, 6-diaminoexanóico |
Histidina | His | H | Ácido 2-amino-3-imidazolpropiônico |
Triptofano | Trp, Tri | W | Ácido 2-amino-3-indolpropiônico |
Metionina | Met | M | Ácido 2-amino-3-metiltio-n-butírico |
Observação: A numeração dos carbonos da cadeia principal pode ser substituída por letras gregas a partir do carbono 2 (α).
Exemplo: Ácido 2-amino-3-metil-pentanoico = Ácido α-amino-β-metil-pentanóico.
Estrutura |
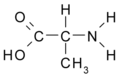
Alanina (Ala / A)
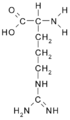
Arginina (Arg / R)
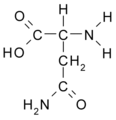
Asparagina (Asn / N)
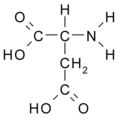
Ácido aspártico (Asp / D)
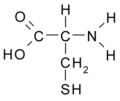
Cisteina (Cys / C)

Ácido glutâmico (Glu / E)

Glutamina (Gln / Q)

Glicina (Gly / G)

Histidina (His / H)

Isoleucina (Ile / I)
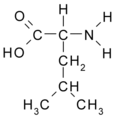
Leucina (Leu / L)

Lisina (Lys / K)
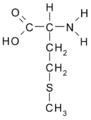
Metionina (Met / M)

Fenilalanina (Phe / F)

Prolina (Pro / P)

Serina (Ser / S)

Treonina (Thr / T)

Triptofano (Trp / W)

Tirosina (Tyr / Y)

Valina (Val / V)
Estrutura tridimensional |
Aminoácidos apolares |
Há um grupo de aminoácidos com cadeias laterais apolares. Desse grupo fazem parte a alanina, a cisteína, a glicina, a valina, a leucina, a isoleucina, a prolina, a fenilalanina, o triptofano e a metionina. Em vários elementos do grupo - isto é, a alanina, a valina, a leucina, e a isoleucina - a cadeia lateral é um grupo hidrocarboneto alifático. A prolina tem uma estrutura cíclica alifática e o nitrogênio está ligado a dois átomos de carbono. Na terminologia de química orgânica, o grupo amina da prolina é uma amina secundária. Em contraste aos grupos aminade todos os outros aminoácidos são aminas primárias. Na fenilalanina, o grupo hidrocarboneto é aromático (contém um grupo cíclico semelhante ao anel de benzeno) em vez de alinfático. No triptofano, a cadeia lateral contém um átomo de nitrogênio adicionado ao grupo hidrocarboneto alifático.

Glicina (Gly / G)
Cisteina (Cys / Cis / C)
Alanina (Ala / A)
Leucina (Leu / L)

Isoleucina (Ile / I)
Valina (Val / V)

Metionina (Met / M)
Prolina (Pro / P)

Fenilalanina (Phe/Fen/F)

Triptofano (Trp / Tri / W)
Aminoácidos polares neutros |
Este grupo de aminoácido tem cadeias laterais polares eletricamente neutras (sem cargas) em pH neutro. Este grupo inclui a serina, a treonina, a tirosina, a glutamina, e a asparagina. Na serina, e na treonina, o grupo polar é uma hidroxila (-OH) ligadas a grupos hidrocarboneto alifáticos. O grupo hidroxila na tirosina é ligado a um grupo hidrocarboneto aromático, o qual eventualmente perde um próton em pHs mais altos.
Asparagina (Asn / N)

Glutamina (Gln / Q)

Serina (Ser / S)
Treonina (Thr / The / T)

Tirosina (Tyr / Tir / y)
Aminoácidos polares ácidos |
Dois aminoácidos, o ácido glutâmico e o [ácido aspártico]], possuem grupos carboxila em suas cadeias laterais, além daquele presente em todos os aminoácidos.

Ácido aspártico (Asp / D)

Ácido glutâmico (Glu / E)
Aminoácidos polares básicos |
Há três aminoácidos (a histidina, a Lisina e a Arginina) que possuem cadeias laterais básicas, e em todos e eles cadeia lateral é carregada positivamente em pH neutro ou perto dele.

Arginina (Arg / R)

Histidina (His / H)
Lisina (Lys / Lis / K)
Classificação quanto ao substituinte |
A classificação quanto ao substituinte pode ser feita em:
Aminoácidos apolares: Apresentam como substituintes hidrocarbonetos apolares ou hidrocarbonetos modificados, exceto a glicina. São substituintes hidrofóbicos.
Alanina: CH3- CH (NH2) - COOH
Leucina: CH3(CH2)3-CH2-CH (NH2)- COOH
Valina: CH3-CH(CH3)-CH (NH2)- COOH
Isoleucina: CH3-CH2-CH (CH3)-CH (NH2)- COOH
Prolina:-CH2-CH2-CH2- ligando o grupo amino ao carbono alfa
Fenilalanina: C6H5-CH2-CH (NH2)- COOH
Triptofano: R aromático- CH (NH2)- COOH: Metionina: CH3-S-CH2-CH2.
Aminoácidos polares neutros: Apresentam substituintes que tendem a formar ligação de hidrogênio.
Glicina: H- CH (NH2) - COOH
Serina: OH-CH2- CH (NH2)- COOH
Treonina: OH-CH (CH3)- CH (NH2)- COOH
Cisteina: SH-CH2- CH (NH2)- COOH
Tirosina: OH-C6H4-CH2- CH (NH2)- COOH
Asparagina: NH2-CO-CH2- CH (NH2)- COOH
Glutamina: NH2-CO-CH2-CH2- CH (NH2)- COOH.
Aminoácidos ácidos: Apresentam substituintes com grupo carboxílico.São hidrófilos.
Ácido aspártico: HCOO-CH2- CH (NH2)- COOH
Ácido glutâmico: HCOO-CH2-CH2- CH (NH2)- COOH.
Aminoácidos básicos: Apresentam substituintes com o grupo amino. São hidrófilos
Arginina: {{{1}}}- CH (NH2)- COOH
Lisina: NH3-CH2-CH2-CH2-CH2- CH (NH3)- COOH
Histidina: H-(C3H2N2)-CH2- CH (NH2)- COOH.
Propriedades |
Organolépticas: Incolores. A maioria de sabor adocicado.
Físicas: Sólidos com solubilidade variável em água. Apresentam atividade óptica por apresentarem carbono assimétrico, em geral,na forma levógira. A glicina é solúvel em água e não apresenta atividade óptica
Químicas: O grupo carboxílico (-COOH) na molécula confere ao aminoácido uma característica ácida e o grupo amino (-NH2) uma característica básica. Por isso, os aminoácidos apresentam um caráter anfótero, ou seja, reagem tanto com ácidos como com bases formando sais orgânicos.
Tabela de abreviaturas e propriedades padrão de aminoácidos |
| Aminoácidos | Símbolo [6] | Abreviação[6] | A classificação quanto ao substituinte | Polaridade[6] | Carga elétrica (pH 7.4)[6] | Hidrófilo index [7] | Absorbância λmax(nm)[8] | ε no λmax (mM−1 cm−1)[8] | Massa molecular | Ocorrência em proteínas (%)[9] | Código genético (Notação da IUPAC) |
|---|---|---|---|---|---|---|---|---|---|---|---|
Alanina | Ala | A | alifático | não polar | neutro | 1.8 | 89.094 | 8.76 | GCN | ||
Arginina | Arg | R | básico | básic polar | positiva | −4.5 | 174.203 | 5.78 | MGN, CGY (também pode ser expressa por: CGN, AGR) | ||
Asparagina | Asn | N | amida | polar | neutro | −3.5 | 132.119 | 3.93 | AAY | ||
Ácido aspártico | Asp | D | ácido | ácid polar | negativa | −3.5 | 133.104 | 5.49 | GAY | ||
Cysteina | Cys | C | contêm enxofre | não polar | neutro | 2.5 | 250 | 0.3 | 121.154 | 1.38 | UGY |
Ácido glutâmico | Glu | E | ácido | ácid polar | negativa | −3.5 | 147.131 | 6.32 | GAR | ||
Glutamina | Gln | Q | amida | polar | neutro | −3.5 | 146.146 | 3.9 | CAR | ||
Glycine | Gly | G | alifático | não polar | neutro | −0.4 | 75.067 | 7.03 | GGN | ||
Histidina | His | H | básico aromático | básic polar | positiva(10%) neutro(90%) | −3.2 | 211 | 5.9 | 155.156 | 2.26 | CAY |
Isoleucina | Ile | I | alifático | não polar | neutro | 4.5 | 131.175 | 5.49 | AUH | ||
Leucina | Leu | L | alifático | não polar | neutro | 3.8 | 131.175 | 9.68 | YUR, CUY (também pode ser expressa por: CUN, UUR) | ||
Lysina | Lys | K | básico | básic polar | positiva | −3.9 | 146.189 | 5.19 | AAR | ||
Metionina | Met | M | contêm enxofre | não polar | neutro | 1.9 | 149.208 | 2.32 | AUG | ||
Fenilalanina | Phe | F | aromático | não polar | neutro | 2.8 | 257, 206, 188 | 0.2, 9.3, 60.0 | 165.192 | 3.87 | UUY |
Prolina | Pro | P | cíclica | não polar | neutro | −1.6 | 115.132 | 5.02 | CCN | ||
Serina | Ser | S | contém hidroxilo | polar | neutro | −0.8 | 105.093 | 7.14 | UCN, AGY | ||
Treonina | Thr | T | contém hidroxilo | polar | neutro | −0.7 | 119.119 | 5.53 | ACN | ||
Triptofano | Trp | W | aromático | não polar | neutro | −0.9 | 280, 219 | 5.6, 47.0 | 204.228 | 1.25 | UGG |
Tirosina | Tyr | Y | aromático | polar | neutro | −1.3 | 274, 222, 193 | 1.4, 8.0, 48.0 | 181.191 | 2.91 | UAY |
Valina | Val | V | alifático | não polar | neutro | 4.2 | 117.148 | 6.73 | GUN |
Curva de titulação |
É muito comum o uso da titulação através da adição ou remoção de prótons para se descobrir características dos compostos. Para aminoácidos essas características também são evidentes. Os valores dessa curva variam entre os aminoácidos. Porém esta tem algumas características em comum.
No início da curva observa-se que os grupos dos aminoácidos carboxilo e amino estão completamente protonados. Com a titulação o grupo carboxílico vai liberar prótons. Durante essa liberação é evidenciado um ponto onde a concentração desse doador de prótons é igual à concentração do íon dipolar desse aminoácido, ponto de inflexão, correspondente a pH igual a pK (medidor da tendência de ceder prótons) do grupo protonado que não está sendo titulado.
O ponto onde se observa o fim da liberação de prótons por parte do carboxilo é o ponto isoelétrico, pI, esse ponto possui um pH caraterístico, onde se observa todo o aminoácido como íon dipolar, ou seja, a carga total é igual a zero.
Com a continuação da titulação, o próton do grupo NH3+ será liberado. Também se observa um ponto de inflexão nessa segunda parte da curva de titulação.
Classificação quanto ao destino |
Essa classificação é dada em relação ao destino tomado pelo aminoácido quando o grupo amina é excretado do corpo na forma de ureia (mamíferos), amônia (peixes) e ácido úrico (aves e répteis).
Destino cetogênico |
Quando o álcool restante da quebra dos aminoácidos vai para qualquer fase do ciclo de Krebs na forma de acetil coenzima A ou outra substância.
Os aminoácidos que são degradados a acetil-coa ou acetoacetil-coa são chamados de cetogênicos porque dão origem a corpos cetônicos. A sua capacidade de formação de corpos cetônicos fica mais evidente quando o paciente tem a diabetes melitus, o que vai fazer com que o fígado produza grande quantidade dos mesmos.
Destino glicogênico |
Quando o álcool restante da quebra dos aminoácidos vai para a via glicolítica.
Os aminoácidos que são degradados a piruvato, a-cetoglutarato, succinil-coa, fumarato ou oxaloacetato são denominados glicogênicos. A partir desses aminoácidos é possível fazer a síntese de glicose, porque esses intermediários e o piruvato podem ser convertidos em fosfoenolpiruvato e depois em glicose ou glicogênio.
Do conjunto básico dos 20 aminoácidos, os únicos que são exclusivamente cetogênicos são a leucina e a lisina. A fenilalanina, triptofano, isoleucina e tirosina são tanto cetogênicos quanto glicogênicos. E os aminoácidos restantes (14) são estritamente glicogênicos (lembrando que o corpo pode gerar Acetil-Coa a partir da glicose)..
Classificação nutricional |
Os aminoácidos se unem através de ligações peptídicas, formando os peptídeos e as proteínas.[10] Para que as células possam produzir suas proteínas, elas precisam de aminoácidos, que podem ser obtidos a partir da alimentação ou serem produzidos pelo próprio organismo.
Os aminoácidos podem ser classificados nutricionalmente, quanto ao radical e quanto ao seu destino.
Aminoácidos não-essenciais |
Aminoácidos não-essenciais ou dispensáveis: São aqueles que o corpo humano pode sintetizar.[11]são eles: glutamina, alanina, asparagina, ácido aspártico, ácido glutâmico, serina.
Aminoácidos essenciais |
Os aminoácidos essenciais são aqueles que não podem ser produzidos pelo corpo humano. Dessa forma, são somente adquiridos pela ingestão de alimentos vegetais ou animais.[11] São eles: fenilalanina,isoleucina, leucina, valina, lisina, metionina, treonina, triptofano, histidina.[12][Nota 2]
Aminoácidos essenciais apenas em determinadas situações fisiológicas |
Aminoácidos condicionalmente essenciais são os aminoácidos que devido a determinadas patologias, não podem ser sintetizados pelo corpo humano. Assim, é necessário obter estes aminoácidos através da alimentação, de forma a satisfazer as necessidades metabólicas do organismo. São eles: cisteína, glicina, prolina, tirosina.[13]
Isomeria |
Os dois enantiômeros da Alanina, D-Alanina e L-Alanina.
Com exceção única da glicina, todos os aminoácidos obtidos pela hidrólise de proteínas em condições suficientemente suaves apresentam atividade óptica. Esses aminoácidos apresentam 4 grupos diferentes ligados ao carbono central, ou seja, esse carbono é assimétrico, assim esse carbono é chamado centro quiral.
A existência de um centro quiral permite que esses aminoácidos formem esteroisômeros devido aos diferentes arranjos espaciais ópticamente ativos. Dentre os esteroisômeros existem aqueles que se apresentam como imagens especulares um do outro sem sobreposição, a estes chamamos enantiômeros.
Os enantiômeros podem ser D ou L, sendo essa classificação referente à semelhança com a estrutura do carboidrato D-gliceraldeído e do L-gliceraldeído, respectivamente. Somente os L-aminoácidos são constituintes das proteínas.
Síntese |
Todos os aminoácidos são derivados de intermediários da glicólise, do ciclo do ácido cítrico ou das via das pentoses-fosfato. O nitrogênio entra nessas vias através do glutamato. Há uma grande variação no nível de complexidade das vias, sendo que alguns aminoácidos estão a apenas alguns passos enzimáticos dos seus precursores e em outros as vias são complexas, como no caso dos aminoácidos aromáticos.
Os aminoácidos podem ser essenciais ou não-essenciais.
- Os aminoácidos não-essenciais são mais simples de serem sintetizados e o são produzidos pelos próprios mamíferos. Por isso eles não necessariamente precisam estar na alimentação.
- Já os aminoácidos essenciais precisam estar presentes na dieta, já que não são sintetizados pelos mamíferos.
As biossintéticas de aminoácidos são agrupadas de acordo com a família dos precursores de um deles. Existe a adição a esses precursores do PRPP (fosforribosil pirofosfato).
As principais famílias são:
- A do alfa-cetoglutarato que origina o glutamato, a glutamina, a prolina e a arginina.
- A do 3-fosfoglicerato de onde são derivados a serina, a glicina e a cisteína.
- O oxaloacetato dá origem ao aspartato, que vai originar a asparagina, a metionina, a treonina e a lisina.
- O piruvato dará origem a alanina, a valina, a leucina e a isoleucina.
Obtenção |
Hidrólise de proteínas
As proteínas são moléculas formadas por até milhares de aminoácidos unidos por ligações peptídicas (que ocorre entre a carboxila de um aminoácido e o grupo amino de outro). Essas ligações podem ser quebradas por hidrólise produzindo uma mistura complexa de aminoácidos.
Síntese
Rearranjo de Hoffmann, síntese de Strecker e síntese de Gabriel são métodos sintéticos para a obtenção de alfa-aminoácidos.

A condensação de dois aminoácidos para formar uma ligação peptídica
Ionização |
Os aminoácidos são substâncias anfóteras, ou seja, pode atuar como ácidos ou como bases.
Existem 2 grupos ácidos fortes ionizados, um –COOH e um –NH3+ . Em solução essas duas formas estão em equilíbrio protônico. R-COOH e R-NH3+, representam a forma protonada ou ácida, parceiras nesse equilíbrio. E as formas R-COO- e R-NH2 são as bases conjugadas.
Assim, dependendo do meio, os aminoácidos podem atuar como ácidos (protonado, podendo doar prótons), neutros (a forma protonada e a forma receptora de prótons em equilíbrio) e base (base conjugada do ácido correspondente, ou seja, perdeu prótons, e agora é receptora deles).
Os aminoácidos reagem com o ácido nitroso produzindo nitrogênio e um hidroxi-acido. A aplicação desta reação é a determinação da dosagem de aminoácidos,no sangue, medindo-se o volume de nitrogênio produzido (método de Slyke).
Na putrefação dos organismos, certas enzimas reduzem os aminoácidos em aminas como a putrescina e a cadaverina.
Outros aminoácidos |
Ácido β-aminopropiônico (β-alanina): aminoácido natural componente do ácido pantotênico (vitamina do grupo B).
Aminoácidos ômega |
Ácido ε-aminocaproico: aminoácido sintético usado na fabricação de fibras sintéticas e de plásticos.
"Aminoácidos" nocivos
Outro tipos de aminoácidos são os ácidos de aminas, que são pequenas particulas unimoleculares incutidas nas amêndoas e amendoins, e que por tanto são altamente nutritivas para as unhas, cabelos e pele.
Notas |
↑ A prolina é uma exceção a esta fórmula geral. Ela não tem o grupo NH2 por causa da ciclização da cadeia lateral e é conhecida como um iminoácido; ela se enquadra na categoria de aminoácidos estruturados especiais.
↑ A arginina é considerada como um aminoácido semiessencial por alguns autores. (em Belitz, H. D; Grosch, W,; Schieberle, P John M (2009). «1. Amino Acids, Peptides, Proteins». Food Chemistry (em inglês) 4ª ed. Berlin Heidelberg: Springer. p. 8-34. 1070 páginas. ISBN 978-3-540-69933-0. doi:10.1007/978-3-540-69934-7 !CS1 manut: Nomes múltiplos: lista de autores (link))
Referências
↑ University of Calgary, Department of Chemistry, Organic Chemistry On-Line Learning Center, Chapter 27: Amino Acids, Peptides and Proteins, Summary [em linha]
↑ ab Sperelakis, Nicholas (editor); Forbes, Michael S. (autor do capítulo); Ferguson, Donald G. (autor do capítulo). «2:Physiological Structure and Functions of Proteins». Cell Physiology Sourcebook. A Molecular Approach (em inglês) 3ª ed. San Diego, California: Academic Press. p. 19. 1235 páginas. ISBN 0-12-656977-0 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2000). Organic Chemistry (em inglês). Oxford: Oxford University Press. p. 165. 1536 páginas. ISBN 0-19850346-6 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ University of Calgary, Department of Chemistry, Organic Chemistry On-Line Learning Center, Chapter 27: Amino Acids, Peptides and Proteins, α-Amino Acids [em linha]
↑ Bolsover, Stephen R.; Hyams, Jeremy S.; Shephard, Elizabeth A.; White, Hugh A.; Wiedemann, Claudia G (2004). Cell Biology (em inglês). Hoboken, New Jersey: John Wiley & Sons. p. 191. 531 páginas. ISBN 0-471-26393-1 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ abcd M., Cooper, Geoffrey (2004). The cell : a molecular approach 3rd ed. Washington, D.C.: ASM Press. ISBN 0878932143. OCLC 52121379
↑ Kyte, J.; Doolittle, R. F. (5 de maio de 1982). «A simple method for displaying the hydropathic character of a protein». Journal of Molecular Biology. 157 (1): 105–132. ISSN 0022-2836. PMID 7108955
↑ ab 1935-, Freifelder, David, (1976). Physical biochemistry : applications to biochemistry and molecular biology. San Francisco: W.H. Freeman. ISBN 0716705605. OCLC 2089552
↑ Kozlowski, Lukasz P. (4 de janeiro de 2017). «Proteome-pI: proteome isoelectric point database». Nucleic Acids Research. 45 (D1): D1112–D1116. ISSN 1362-4962. PMID 27789699. doi:10.1093/nar/gkw978
↑ University of Calgary, Department of Chemistry, Organic Chemistry On-Line Learning Center, Chapter 27: Amino Acids, Peptides and Proteins, Terminology and Conventions for Peptides and Proteins [em linha]
↑ ab Newton, David E (2007). Food Chemistry (em inglês). New York: Facts on File. p. 67. 212 páginas. ISBN 978-0-8160-5277-6
↑ Belitz, H. D; Grosch, W,; Schieberle, P John M (2009). «1. Amino Acids, Peptides, Proteins». Food Chemistry (em inglês) 4ª ed. Berlin Heidelberg: Springer. p. 8-34. 1070 páginas. ISBN 978-3-540-69933-0. doi:10.1007/978-3-540-69934-7 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Macronutrients., Institute of Medicine (U.S.). Panel on; Intakes., Institute of Medicine (U.S.). Standing Committee on the Scientific Evaluation of Dietary Reference (2005). Dietary reference intakes for energy, carbohydrate, fiber, fat, fatty acids, cholesterol, protein, and amino acids. Washington, D.C.: National Academies Press. p. 593. 1358 páginas. ISBN 0309085373. OCLC 57373786
Bibliografia |
- CAMPBELL, Mary K. Bioquímica. 3º edição, Artmed, 2006.
Ver também |
Categoria:Aminoácidos, todos os artigos sobre aminoácidos- Experiência de Miller e Urey
- Sequência de DNA
- Aminoácido proteinogénico
- Código genético
Ligações externas |
- Commons
- Commons
- Wikilivros







































